红网时刻新闻6月11日讯(通讯员 孙执豪)近日,南华大学陈志明教授团队证实GAK-Hsc70复合体通过促进新生网格蛋白晶格重构驱动细胞质膜内陷,相关研究成果在PNAS发表。南华大学陈志明教授、美国科学院院士Sandra L. Schmid为本文共同通讯作者,南华大学基础医学博士研究生贺樟平为第一作者。
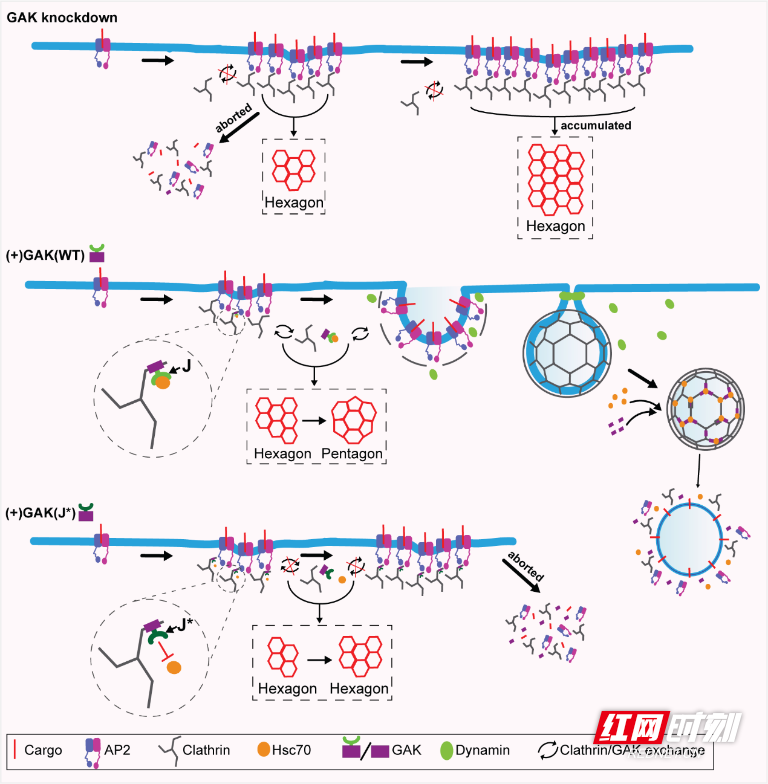
网格蛋白介导的胞吞作用(clathrin-mediated endocytosis,CME)是一种重要的细胞过程,负责介导多种货物分子的内化,包括营养物质、信号受体、跨膜离子通道及转运蛋白,其功能失调与包括癌症、神经退行性疾病和心血管疾病在内的多种疾病有关。CME起始于网格蛋白在细胞质膜上组装形成网格蛋白包被小窝(clathrin-coated pits, CCP),进而内凹闭合并脱离质膜形成包裹着货物的网格蛋白包被囊泡(clathrin-coated vesicles, CCV)。活细胞全内反射荧光显微镜(TIR-FM)研究显示:相当比例的初始CCP(称为流产性CCP)会在成熟过程的不同阶段失败并快速解聚,形成有效小窝的关键阶段需要早期曲率生成和CCP内陷,而短寿命的流产性小窝通常呈现低荧光信号和扁平形态特征;电镜研究表明,扁平网格蛋白晶格几乎完全由六边形阵列构成,而弯曲晶格则同时包含六边形和五边形结构。虽然观察到某些中间结构被认为代表产生曲率所需的六边形向五边形转变,但这一观点仍存在争议且驱动网格蛋白晶格从扁平到弯曲的转变分子机制仍不清楚——成为生物医学亟需厘清破解的重大“谜团”。
机理图。
陈志明教授率领团队针对以上关键科学问题开展攻关研究,发现并证实:GAK基因(细胞周期蛋白G相关激酶)敲除会抑制CCPs的稳定化和内陷过程;当GAK的J结构域发生突变导致热休克蛋白Hsc70无法被募集并激活于CCPs时,会引发GAK在CCPs上的异常积聚,阻碍CCPs的稳定化与内陷,并显著增加高度瞬时性流产CCPs的比例。这些发现揭示了网格蛋白晶格重构的分子机制,支持GAK-Hsc70复合体可通过促进网格蛋白三脚复合体更替和晶格重构来推动CME事件所需的扁平向弯曲转变这一假说,为破解相关疾病发生、发展机制奠定重要的理论基础。
来源:红网
作者:孙执豪
编辑:蒋楠
本文为衡阳站原创文章,转载请附上原文出处链接和本声明。